CD103+ T细胞是存在于外周组织中的长期驻留性T细胞亚群,其在塑造组织特异性免疫微环境中发挥重要作用。在狼疮肾炎(LN)中,已在肾组织内鉴定出具有病理潜能的CD103⁺ T细胞,发现其直接参与肾实质的免疫损伤与疾病慢性化进程。因此,阐明该T细胞亚群在LN组织中的分化机制,将为干预LN提供重要的治疗窗口。
近日,苏州大学生物医学研究院温振科教授团队在PNAS发表题为Glomerular endothelial cells eliminate nicotinamide adenine dinucleotide to instruct CD103+ T cells in human lupus nephritis的研究,首次揭示:狼疮肾炎(LN)患者肾小球血管内皮细胞(EC)可通过CD38调控CD4+ T细胞内NAD+水平、驱动CD4⁺CD103⁺ T细胞分化,深入解析从DNA感知到T细胞表观遗传重塑的调控机制,为LN精准治疗提供了全新靶点与理论依据。

研究团队在LN患者肾脏组织中观察到CD4⁺CD103⁺ T细胞显著富集,且其与疾病活动度密切相关;在人源化SLE疾病模型中,清除肾脏CD103⁺ T细胞可显著缓解疾病进展。进一步通过共培养体系发现,LN肾小球血管内皮细胞具有促CD103⁺ T细胞分化的能力,其关键作用依赖于上调T细胞内的转录因子Blimp-1。
在机制层面,该研究揭示了一条跨越细胞类型的信号轴:自身DNA通过cGAS-STING通路激活肾小球血管内皮细胞,触发其CD38表达显著上调;随后,活化的内皮细胞通过外泌体将CD38递送至CD4⁺ T细胞,导致T细胞内NAD+耗竭;NAD+水平的下降削弱了由PARP1催化的EGR1的ADP-核糖基化修饰,从而释放T细胞EGR1的转录活性;最终,EGR1上调关键转录因子Blimp-1表达,驱动CD4⁺ T细胞分化为CD103⁺ T细胞,重塑肾脏局部免疫微环境。
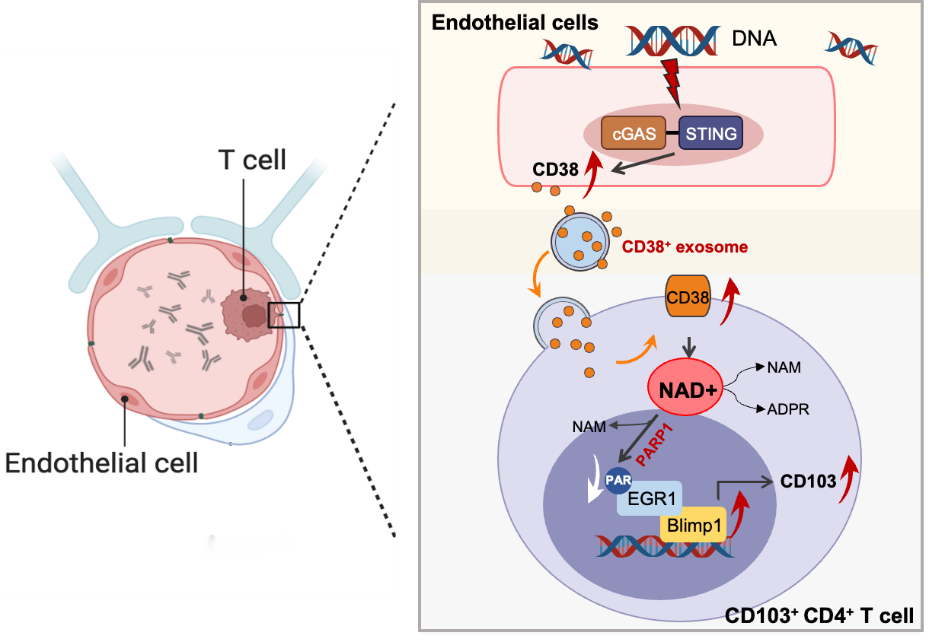
在人源化疾病模型及基因工程小鼠中,研究团队证实靶向抑制cGAS/STING–CD38–EGR1-Blimp-1轴可有效阻断肾脏CD103⁺ T细胞累积,并显著缓解LN疾病进展。
该研究系统揭示自身DNA通过肾小球血管内皮细胞重塑LN肾脏组织区域CD103+ T细胞分化调控的新机制,亦为致病性T细胞在组织区域的分化研究提供新的研究范式。靶向肾小球血管内皮细胞介导的T细胞代谢重编程,有望为狼疮肾炎带来新的治疗策略。
苏州大学生物医学研究院博士贾力、博士后刘梦迪、博士冀慧雁为共同第一作者,温振科教授是独立通讯作者。工作得到国家海外高层次人才、国家自然科学基金面上项目、江苏卫生创新团队、江苏特聘教授和江苏省杰出青年基金等项目支持。
