肿瘤干细胞在肿瘤起始、耐药、转移及复发中具有关键作用,是临床治疗的痛点和难点。既往研究主要聚焦于肿瘤干细胞的表型、代谢及其与普通肿瘤细胞的功能差异,其免疫调控功能基本未知。
近日,苏州大学生物医学研究院温振科教授团队在《Advanced Science》发表合作研究成果:首次揭示肿瘤干细胞的免疫调控功能,解析其抑制CD103+ T细胞分化的核心机制,为突破肿瘤免疫治疗瓶颈提供了全新方向。

作为肿瘤微环境(TME)中的“抗癌卫士”,CD103+ T细胞可通过分泌干扰素-γ(IFN-γ)、颗粒酶B等细胞因子,高效杀伤肿瘤细胞,发挥强效抗肿瘤作用。临床研究也已证实,肿瘤组织中CD103+ T细胞的浸润水平与患者的预后高度相关。然而,肿瘤微环境是否以及如何调控这类细胞的分化,长期以来都是未解之谜。
温教授团队整合临床样本、肿瘤类器官模型及人源化肿瘤模型等证实:肿瘤干细胞具备特异性、选择性抑制CD103+ T细胞分化的能力,并主要通过转运乙酰辅酶A发挥免疫抑制作用。这些被转运的乙酰辅酶A进入T细胞后,会诱导CD103+ T细胞关键转录因子Blimp-1发生乙酰化修饰,而乙酰化修饰后的Blimp-1与E3泛素连接酶LIS1的相互作用显著增强,进而加速Blimp-1的泛素化降解过程。这一系列事件最终导致CD103+ T细胞分化受阻,抗肿瘤免疫应答被大幅削弱。这一机制的发现,首次阐明了肿瘤干细胞具有调控T细胞应答的能力,为解析肿瘤免疫抑制提供了全新视角。
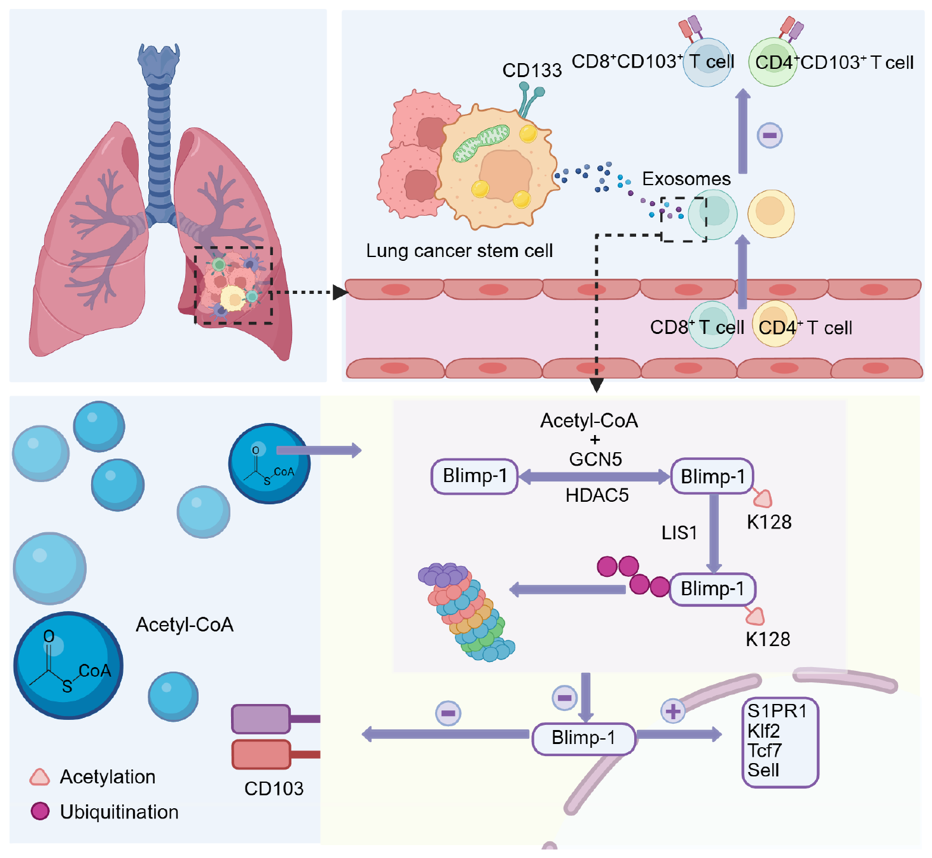
基于这一核心机制,研究团队利用患者来源类器官模型、人源化肿瘤模型开展靶向干预研究,发现抑制肿瘤干细胞乙酰辅酶A合成、阻断肿瘤干细胞外泌体分泌、或靶向T细胞Blimp-1乙酰化及泛素化修饰,可恢复CD103+ T细胞分化功能,逆转免疫抑制微环境,并限制肿瘤进展。
该研究首次报道肿瘤干细胞的免疫编辑功能,揭示了肿瘤干细胞异常代谢调控免疫应答的全新机制,为后续开展转化医学研究、开发精准靶向药物奠定了坚实基础,为癌症精准治疗提供了新的方向。
苏州大学生物医学研究院博士生雷嘉欣、冀慧雁、及博士后郭晶为共同第一作者,温振科教授是最后通讯作者,上海交通大学桂俊教授和任涛教授是共同通讯作者。工作得到国家海外高层次青年人才、江苏卫生创新团队、江苏特聘教授、江苏省杰出青年基金等项目支持。
原文链接:https://advanced.onlinelibrary.wiley.com/doi/10.1002/advs.202513535
