DNA是生命体遗传信息的核心载体,当其因各类因素 “逃逸” 到细胞质或循环中,可引发固有免疫及适应性免疫应答。然而,DNA已有研究主要聚焦在固有免疫细胞,适应性免疫细胞对DNA的识别、应答及调控是免疫学领域尚未解决的基本科学问题。
近日,苏州大学生物医学研究院温振科教授团队在免疫学与过敏学领域顶刊《Clinical Reviews in Allergy & Immunology》发表题为《The Immunogenic Role of Self-DNA in T Cell Immunity》的综述,系统性揭示了自身DNA作为“T细胞免疫主动调控者”的角色:既能驱动自身免疫疾病发生,又能影响抗肿瘤免疫应答,为重大慢性疾病的机制研究与治疗开发提供了全新视角。

生理状态下,细胞具备高效清除 “逃逸” 自身DNA的机制,避免其异常累积。然而,当细胞死亡、基因组不稳定、线粒体功能失调,加之DNA修复或清除相关的酶缺陷时,大量自身DNA会在胞内或循环中累积。这些累积的自身DNA具备激活免疫应答的能力;但传统研究认为,自身DNA主要通过树突状细胞、巨噬细胞等固有免疫细胞间接影响T细胞,而T细胞如何直接响应自身DNA鲜有报道。
温教授团队聚焦自身DNA在适应性免疫细胞中的识别、应答及调控,指出T细胞本身即可表达DNA感受器(如ENPP1),能够直接“感知”细胞质内的自身DNA,并进而决定其细胞命运。在系统性红斑狼疮中,自身DNA通过ENPP1识别、重塑T细胞代谢并驱动致病性T细胞分化;在类风湿关节炎中,自身DNA积累可引发T细胞焦亡和衰老;这种直接识别为理解自身免疫病中T细胞为何“倒戈攻击”自身组织提供了全新解释。在肿瘤患者,自身DNA的角色更为复杂;一方面,放疗、化疗导致的肿瘤细胞死亡会释放自身DNA,进而通过固有免疫识别炎性应答促进抗肿瘤T细胞免疫应答;另一方面,肿瘤细胞也会“劫持”这一机制,通过自身DNA固有免疫识别重塑其自身代谢特征及免疫调控功能,诱导肿瘤组织区域免疫抑制微环境。
温教授团队亦重点探讨了自身DNA的适应性免疫识别。已有研究发现,具有免疫原性的自身DNA是T细胞依赖抗原,驱动IgG自身抗体产生并参与系统性红斑狼疮发病,提示T细胞通过TCR识别自身DNA的可能性。然而,目前自身DNA抗原提呈及其被TCR识别的具体分子模式仍不清楚,揭示这一机制将是免疫学领域的颠覆性进展。
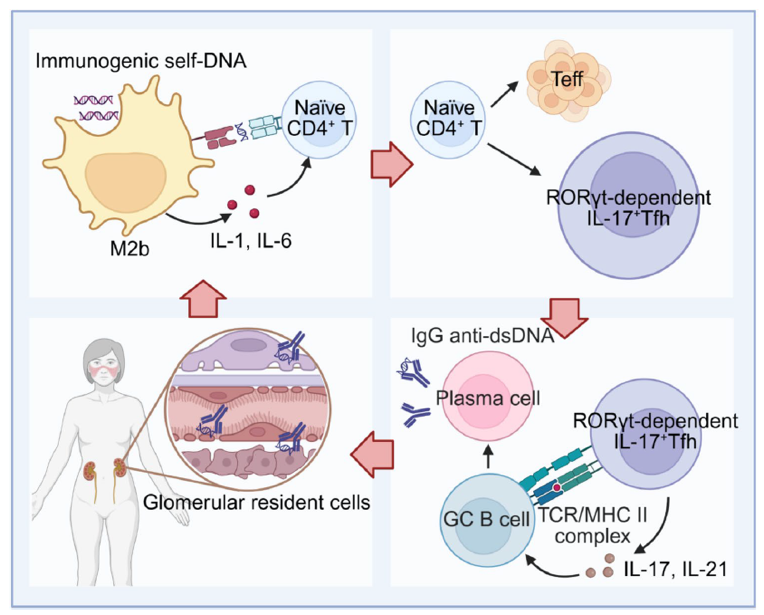
该综述推动对自身DNA的理解经历一场范式转移,阐述自身DNA不仅是一个被动的损伤标志物,更是一个主动的免疫调控者。深入揭示自身DNA与T细胞互作的分子机制,将为开发自身免疫病、癌症和感染性疾病的全新免疫疗法奠定坚实基础。
苏州大学生物医学研究院博士研究生雷嘉欣是独立第一作者,温振科教授是独立通讯作者;工作得到国家海外高层次青年人才、江苏卫生创新团队、江苏特聘教授、江苏省杰出青年基金等项目支持。
原文链接: https://doi.org/10.1007/s12016-025-09111-9
