2024年8月29日,我院杨鑫教授团队在生物学期刊Journal of Molecular Cell Biology在线发表研究论文:PHLDA2 is critical for p53-mediated ferroptosis and tumor suppression,阐明PHLDA2在p53介导的铁死亡和肿瘤抑制中的关键作用。
抑癌因子p53失活是肿瘤形成的关键因素,因此探索p53在肿瘤抑制中的精准调节机制将有助于改善肿瘤治疗策略。细胞周期阻滞、衰老和凋亡是p53在应激反应和肿瘤抑制中主要发挥的经典功能。然而,越来越多的研究发现,即使p53缺失这三种活性,依然能够通过转录调控促进铁死亡抑制肿瘤形成。尽管 p53 激活能够调节 GPX4 抑制剂诱导的铁死亡反应,但在没有常见铁死亡诱导剂的条件下,p53 介导的肿瘤抑制与高水平活性氧 (ROS) 诱导的铁死亡途径更密切相关,且主要由脂氧合酶 ALOX12所调控。进一步研究表明,PHLDA2 能够识别磷脂酸并通过募集 ALOX12 来诱导其过氧化,从而抑制肿瘤发生。由于PHLDA2可以在体内天然的诱导铁死亡,而无需使用常见的铁死亡诱导剂,因此PHLDA2 对肿瘤抑制至关重要。本研究发现PHLDA2是p53介导的高ROS诱导的铁死亡所必需的。PHLDA2依赖的铁死亡对于p53介导的肿瘤抑制发挥关键作用,且独立于ACSL4依赖的铁死亡。该论文与杨鑫教授2024年Cell Metabolism研究成果一脉相承,系统的阐述p53-ALOX12-PHLDA2轴通过调控铁死亡介导的肿瘤抑制可以作为肿瘤治疗的潜在靶点。
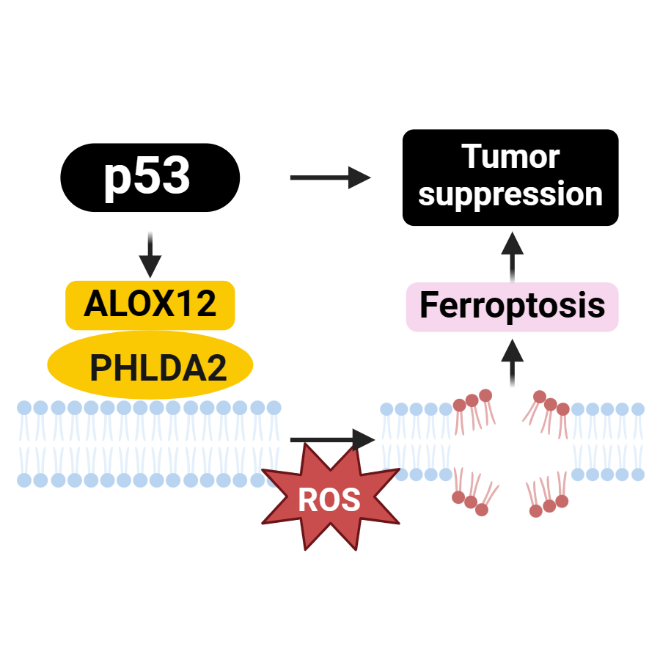
杨鑫教授为该论文的第一作者,美国纽约哥伦比亚大学顾伟教授为论文通讯作者。
论文链接:https://academic.oup.com/jmcb/advance-article/doi/10.1093/jmcb/mjae033/7745500?login=false
另外,2024年9月10日,我院杨鑫教授课题组与山东大学初波教授课题组和深圳湾实验室尹成骞课题组联合在Trends in Cell Biology发表题为:Gut microbial metabolism in ferroptosis and colorectal cancer的综述论文,详细阐述了肠道微生物代谢,并讨论了这些来自肠道菌群的代谢物如何通过铁死亡调控肿瘤可塑性,提出靶向肠道微生物介导的铁死亡可以作为结直肠癌(CRC)治疗的潜在策略。
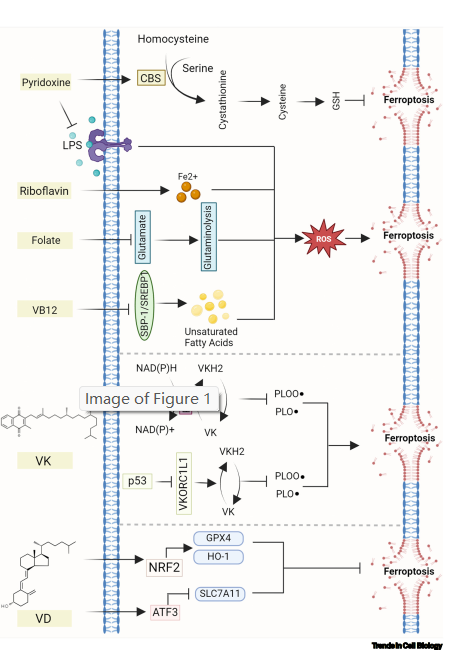
杨鑫教授、初波教授和尹成骞教授为论文共同通讯作者。
论文链接:https://www.cell.com/trends/cell-biology/abstract/S0962-8924(24)00163-6
